一个来自清华,一个来自北大,却在这里撞出火花!
2025年10月21日
这是昌平实验室的第一篇背对背
他们携手研发了极具转化前景的
放射响应免疫小分子前药
而这背后的故事
更加生动、感人
昌平实验室,让T(THU)-P(PKU)link 起来
“一拍即合、相见恨晚”的“幸福邂逅”

昌平实验室领衔科学家傅阳心,刻在骨子里的谦和、儒雅。即便是讲深奥的药理,还是能深入浅出,言简意赅。傅老师83年毕业于上海医科大学,86年协和医院临床研究生毕业,90年获得美国迈阿密大学医学微生物学和免疫学博士学位。之后,从华盛顿大学住院医师,到芝加哥大学终身教授、再到德州大学西南医学中心病理系冠名教授,是少数同时在医学和基础科研领域都取得突出成绩的医生和科学家。2021他全职回清华大学任基础医学院肿瘤中心主任,成为清华大学肿瘤学科带头人。“找到一个化学家,把毒性很大的免疫激动剂制成小分子前药”是傅老师多年的心愿。
刘志博,昌平实验室领衔科学家,北京大学化学与分子工程学院教授,副院长,应用化学系主任,国家杰出青年基金获得者。“研发新的放射性药物,救治更多肿瘤患者”成了刘志博老师回国九年来锚定的目标。缩小中国放射性药物研究和世界前沿水平的差距,如何从跟跑到并跑,甚至实现领跑,成了他最大的梦想。深耕放射性药物领域,开发基于放射性独特优势的新型化学工具成为他日复一日的坚持。
没想到缘分竟是这样奇妙!一个是学术前辈,一个是科研新星,两代科学家,来自不同领域,不同学校,却在昌平实验室有了“幸福的邂逅”!“一拍即合,相见恨晚”他们不约而同地用了这样美妙的词汇来描述他们的相遇,相知。
放疗响应免疫小分子前药这个课题正是源于一次联合 PI 例会,两位科学家把“临床想要什么”与“化学能做到什么”扣在一起,正是昌平实验室,让 T-P Link 成真。“短短半小时决定科研方向,科研成果给出大大惊喜,科研转化已经上马!” 说起项目的缘起,他们记忆犹新。
新技术三大核心优势
打一针就可以治疗肿瘤?
放疗激活前药技术,让放疗与免疫真正协同
只需在放疗前打一针,就能实现肿瘤治疗?这听起来如同天方夜谭的设想,如今有望成为现实。两位老师合作借助新型放射免疫联合治疗技术,成功研发出放射响应免疫小分子前药。这种药物如同为副作用较强的肿瘤免疫药装上了 “智能开关”,不仅能让药物在病灶部位实现定向“爆破”,还能激活人体自身的免疫细胞,使其主动搜寻远端扩散的肿瘤细胞,并“吃掉它”。这项研究也展示瘤内DC对T 细胞教育作用及这些T细胞对远端肿瘤控制作用。
能够实现 “定点、定时、定量” 的三大核心优势,是肿瘤免疫治疗的一个突破!将毒性很大的免疫激动剂加上小分子前药,使得药进入身体后无毒无活性,而经过放疗照射后,药物活性在肿瘤处定点足量发挥作用。基于放疗激活前药(RAP)技术平台,他们联合研发出放射响应的免疫小分子候选药物 O-IMDQ:药物在放疗射线照射下于病灶局部“解锁”并定点激活,继而启动自身免疫系统,同步清除原位肿瘤与远端转移灶说起这一构想的实现,两位老师都难掩激动。
以终为始,让成果转化跑出加速度
药物还在研发阶段,就有很多药企等着转化“研究真问题,真研究问题”是昌平实验室的slogan,而两位在成果转化上都颇有心得的科学家,在这次创新药转化上也跑出了“加速度”。近年来,傅阳心老师主持开发了新一代双特异性抗体、融合蛋白、细胞因子前药和抗体前药用于肿瘤免疫治疗,很多已应用于不同阶段的临床试验,展现出了极大的应用前景和价值。而刘志博团队立足自研设备,实现了Ac-225、Y-86等紧缺医用核素的国内首次制备,团队开发的多个核药物分子已开展临床研究,并做为“一类创新药”获批临床批件。
正是带着“以终为始,实现突破”的共同愿景,傅阳心和刘志博团队也正在积极推动药物的成果转化,一日不敢耽搁。“希望未来,当世界上提到癌症治疗方案的重大发现时,有我们中国人一席之地!”
权威发布
刘志博、傅阳心团队 | Nature Communications同期背靠背
科学原理和发现
昌平实验室/北京大学的刘志博团队和昌平实验室/清华大学的傅阳心团队合作在Nature Communications期刊同期发表了两篇关联性论文,分别题为:Single Atom Engineering for Radiotherapy-Activated Immune Agonist Prodrugs和Orchestrating Intratumoral DC-T Cell Immunity for enhanced Tumor Control via Radiotherapy-activated TLR7/8 prodrugs in mice。两篇论文分别从前药开发技术和生物学机制角度共同阐述了一种创新性免疫治疗策略:通过放疗实现肿瘤靶向的免疫激动剂前药激活,避免系统毒副作用的同时,在肿瘤局部诱导强劲的免疫反应,实现放疗的 “远端效应” 。
刘志博项目组开发的放疗响应药物(Radiotherapy-Activated Prodrug, RAP)技术是一类将低毒性的前体药物经放疗射线照射激活、恢复高活性的治疗技术。
为什么想到用放疗结合化疗药呢?正是因为现代放疗技术的“三性”,即肿瘤靶向性、组织穿透性(深达15厘米以上)、高临床相关性(60%以上癌症病人需要接受放疗)。给药后在暴露于放疗照射区域前保持低毒性,被放疗射线辐照时会发生化学反应,分子结构转变为高活性的形式,对照射区域内的病灶处产生治疗效果。
本次背靠背发表的第一篇论文起源于刘志博课题组2022年发展的活体辐射化学:放疗驱动的氮氧化物(N-oxide)脱氧反应。在本研究中,针对免疫治疗药物(免疫激动剂IMDQ)存在的毒副作用问题与靶向递送需求,作者应用RAP技术开发了单原子工程化的放疗响应的免疫激动剂前药(O-IMDQ),通过计算机辅助的药物设计,利用单个氧原子的化学修饰给IMDQ的活性“上锁”,其活性(EC50值)可被抑制4000倍以上,使其在进入体内后处于“沉默”状态。此后,在肿瘤内通过放疗照射“解锁”恢复药物活性。
在临床前荷瘤小鼠模型上,系统给药之后的肿瘤局部放疗高效释放IMDQ原药,引起肿瘤消退、并抑制未辐照远端肿瘤的生长。通过这种“系统给药+局部激活”的新颖方式,避免了全身毒性的发生,有望突破免疫治疗中的“疗效-毒性”矛盾。此外,该平台技术可针对其他多种靶点开发高原子经济性(仅单个氧原子修饰)的放疗响应药物,为临床放射联合化疗/免疫治疗提供了新对策。
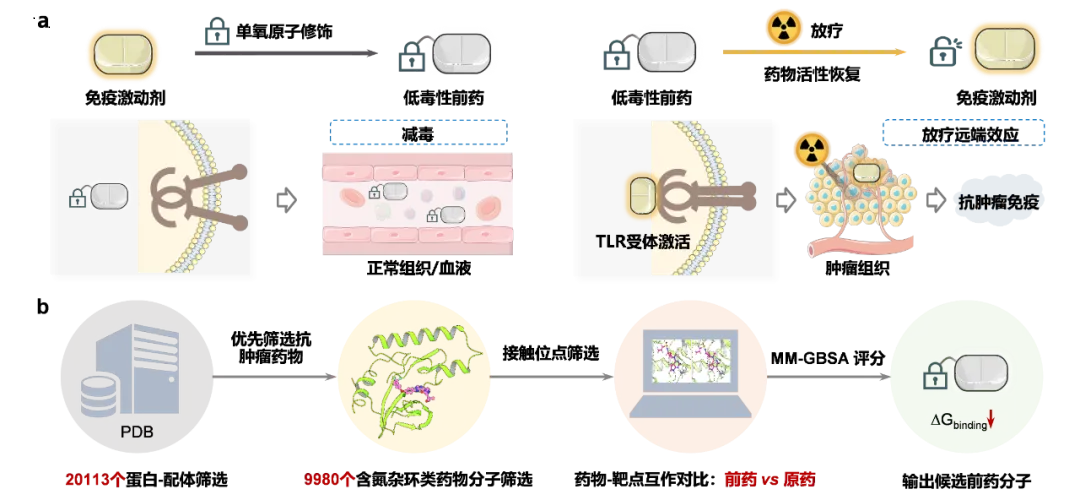
RAP平台技术为探究肿瘤内的免疫反应提供了创新性的技术支持,因此,第二篇论文重点解析肿瘤内DC-T细胞轴的免疫反应及其对肿瘤治疗的内在机制。在此项工作中,傅阳心团队利用刘志博团队开发的RAP技术与O-IMDQ前药分子,探究肿瘤局部的激活作用机制。研究显示,放疗激活后产生的IMDQ激动剂能够有效激活肿瘤内的树突状细胞(cDCs),进而增强其抗原呈递功能,促进肿瘤浸润性T细胞(TILs)增殖与活化。值得关注的是,这种免疫激活效应并非依赖引流淋巴结中新T细胞的招募,而是依靠肿瘤内部既有T细胞的重新赋能,这一发现进一步强调了局部免疫激活的核心地位。进一步机制研究揭示,STING和MyD88信号通路协同调控了I型干扰素的产生,从而驱动DC介导的T细胞激活,形成以肿瘤微环境为中心的免疫循环。
长期以来,实现放疗联合免疫治疗的“远端效应”一直是临床难题。高剂量放疗虽能清除原发肿瘤,却可能损伤肿瘤浸润T细胞(TILs);而低剂量放疗则常难以激活足够免疫反应。在本研究中比较不同放疗方案后发现,只有低剂量分次放疗(如4 Gy ×3 或 6 Gy ×3)能够在不损伤TILs的前提下有效激活RAP。而且肿瘤内激活的T细胞出了被照射部位进入引流淋巴系统从而巡查人体各处猎杀远瑞深藏小股肿瘤细胞。
综上,两项研究以RAP技术开发为起点、以免疫激活的机制为应用场景和目标科学问题,探索了放疗引导下局部免疫“点火”机制,成功构建出兼具疗效与安全的新型抗肿瘤策略。通过激活肿瘤微环境中DC-T细胞轴,RAP策略有望成为放疗与免疫治疗协同进展的重要支点,也为提升当前肿瘤治疗的精准性与有效性提供了值得关注的新方向。未来,该策略有望与抗体、mRNA疫苗、CAR-T疗法等组合,进一步提升系统性抗肿瘤免疫的广度与深度。
两项研究的通讯作者是昌平实验室/北京大学刘志博教授和昌平实验室/清华大学基础医学院傅阳心教授。昌平实验室刘志博组副研究员丁泽轩博士、清华大学尹晓哲博士、北京大学博士生郑越丹、李奕言为第一篇文章开发单原子工程化RAP平台技术的共同第一作者,尹晓哲博士、丁泽轩博士、清华大学余莉博士为第二篇文章探索抗肿瘤免疫机制的共同第一作者。